推动相关标准协调统一,并在合规前提下促进行业创新,有望提升医疗器械在海外市场的可及性。
当前,医疗器械行业发展迅猛态势持续。行业趋势显示,亚太地区成为该行业全球扩张速度领先的区域,主要原因如下:
临床需求——非传染性疾病(尤其是心血管疾病和糖尿病)的患病率居高不下且持续高发;传染病频发;近年来诊断检测、住院治疗和外科手术量显著上升;
人口增长与结构变化——人口基数持续扩大,65岁以上人口快速增长,叠加公众健康意识与求医需求提升等因素;
投资机会——中华人民共和国(中国)和印度等国的主要医疗器械制造商日益重视开拓新兴商机;各类金融机构与风险投资企业正带来多元投资机遇;
政府扶持——通过设立生产挂钩激励机制、建设医疗器械制造园区、加速审批流程及优化政策环境等手段,政府为初创研发企业及本土制造业提供支持。
随着行业快节奏增长,凸显相关法律法规制定完善的必要性,以确保产品安全、效能和质保符合标准。医疗器械法律法规涵盖合规标准、指南及法律体系,贯穿研发到流通全生命周期,旨在保障公众健康。
图:医疗器械典型生命周期内的法规与评估
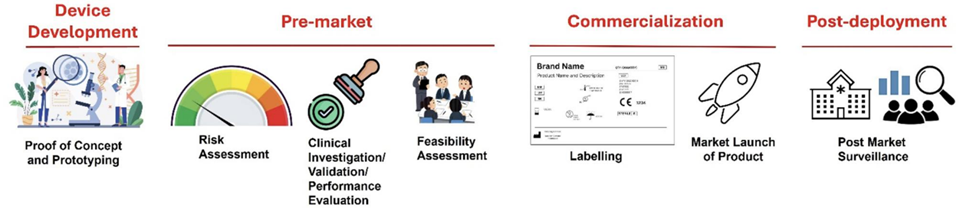
资料来源:卫生健康适宜技术项目(PATH),2024年。
2017年,世界卫生组织(世卫组织)制定了《医疗器械(包括体外诊断医疗器械)全球示范监管框架》,强调国家监管机构和立法机关在建立、实施与执行医疗产品相关法律和监管框架方面的责任。2023年,世卫组织对该框架范围进行了修订,纳入了医疗器械紧急使用授权、边界产品、医疗器械捐赠、医疗器械软件(SaMD)等新兴议题以及组合产品的监管路径,并阐明了医疗器械本地生产和检测政策。目前,这一全球框架业已成为将医疗器械指标纳入世卫组织全球基准工具的一项标准。
预计2023-2030年,亚太地区医疗器械市场年复合增长率将达到7.3%。据亚太医疗技术协会(APACMed)预测,医疗器械企业对亚太地区国内生产总值(GDP)的贡献率有望达到2%。推动和维持这一势头的两大因素包括技术进步和监管生态系统的强化,其中涉及标准统一和对评估程序的依从。
然而,从国家监管机构的成熟度来看,亚太地区各经济体之间存在显著差异。澳大利亚、日本和新加坡已建立起高度完善、与国际接轨的监管机构,而印度等国仍在不断发展本国监管机构,以满足市场对医疗器械性能、安全性和有效性日益增长的需求。在文莱、格鲁吉亚、蒙古国、东帝汶等中低收入国家,情况更为严峻:或尚未建立独立的医疗器械监管机构而由国家卫生部代行职责,或已设立监管机构但其能力仍然有限。
各国通常依据医疗器械对人体可能造成的风险对其进行分类,但具体级别或类别数目有所不同。在基于风险的分类体系下,潜在风险越高,监管力度越强。法规要求可能涵盖注册、许可和国内临床试验等环节,不同国家的要求也有所不同。
在技术飞速发展和医疗器械行业全球化的背景下,推动各国医疗器械法规的协调统一显得尤为必要。
亚太地区拥有庞大且持续增长的人口基数,经济发展不均衡,国家监管机构的成熟度差异显著,这使得推动监管协调的重要性不言而喻。此外,随着越来越多的国家加入双多边贸易协定,协调还有助于减少谈判中的非关税壁垒和合规问题,从而利好医疗器械贸易。为此,澳大利亚治疗商品管理局、日本药品和医疗器械管理局及中国国家药品监督管理局早已加入国际医疗器械监管者论坛(IMDRF)。为实现与国际法规接轨,韩国食品药物安全部和印度中央药品标准控制组织开展了大量工作,后者最近成为了IMDRF的附属会员。
新加坡和日本正成为各国建立监管信赖的“参照国”。新冠疫情期间,泰国食品药品监督管理局树立了成功范例。该局基于新加坡卫生科学局的安全评估和绩效结果对医疗器械进行考量,促成了新泰之间正式监管信赖途径的建立,这也是亚太地区首条此类途径。
菲律宾推行的一项举措在东盟内部促进了监管信任的构建。该国通过优化新加坡、泰国、印尼及马来西亚的信息提交方式,显著提升了审批效率。为提升审批效率,越南将韩国食药安全部与中国药监局纳入参考市场范围。2015年达成的《东盟医械指令》确立了区域医疗器械法规的统一框架。
为提升医疗资源效能,WHO推动实施可信赖操作规范,确保及时获得安全、有效且优质的医药产品,同时在公共卫生紧急事件中强化监管准备与应对能力。2023年,美国FDA公布了《医疗器械与放射健康中心国际协调战略计划》(草案),该计划建议在特定情况下促进监管机构之间的医疗器械监管协调、趋同与信赖。同时,欧洲EMA正在加强符合性评估监管,规定在欧洲经济区销售的产品必须加贴CE标识。
医疗设备若无法兼顾经济性与可靠性,将对民众健康造成严重威胁,并可能使家庭因巨额医疗开支陷入经济困境。建立确保医疗设备安全且价格合理的运行机制,是控制过高医疗成本的核心举措。
有效的监管体系有助于推进医疗产品的本土化进程,保障其安全且经济地进入市场。然而,繁琐的审批流程和复杂的监管要求可能阻碍新技术的应用。由于高昂的成本和严格的监管,亚太地区的发展中国家在医疗器械制造领域以及主要依赖进口的低收入国家,常常面临创新瓶颈。为挖掘区域发展潜能,多方利益主体应协同努力,国际组织需发挥积极作用,各国监管机构无论发展程度如何都应紧密配合。强化监管一致性、统一性和互信度,能有效节约各国监管部门的成本与时间,特别是在突发公共卫生事件期间。
为应对新兴技术发展,各国应提前规划,确立医疗设备软件及AI驱动的数字化健康方案的技术规范与实施框架,同时推进数据存储与共享的创新实践。通过卫生技术评估,可为新技术应用的决策提供科学支撑。当前举措需结合国际规范持续推进,同时必须细化医疗设备价格管控政策,在确保创新动力的前提下解决医疗支出管控难题,这对资源匮乏地区具有特殊意义。
本文作者
朴雅卡·巴贾杰(Priyanka Bajaj)
PATH卫生健康技术创新专家
迪维亚·瓦希·玛利克(Divya Wahi Malik)
PATH技术与创新项目官员
斯瓦特·玛哈詹(Swati Mahajan)
PATH(南亚)卫生系统事务主管
瓦顺达拉·然普沙旺(Vasoontara Sbirakos Yiengprugsawan)
亚行行业发展局人类和社会发展分局全民健康覆盖高级专家(服务交付)
金在均(Jae Kyoun Kim)
亚行行业发展局人类和社会发展分局卫生专家
更多阅读:

