由于摄入大量脂肪会增加代谢紊乱的风险,高脂饮食一直被列在营养师的黑名单中。而加州大学欧文分校(UCI)的生物学家在如何避免高脂肪饮食造成的有害影响方面取得了重要发现。他们的研究发表在 Nature Communications 上。
AMPK 是维持体内代谢平衡的关键蛋白复合物
UCI的研究集中在 AMPK 蛋白质复合物上,它可以感知身体的营养并采取行动保持平衡。例如,如果 AMPK 检测到葡萄糖含量低,它可以促进脂质分解以产生能量。因此,AMPK 的激活已成为治疗与代谢紊乱相关疾病(如糖尿病、肥胖、脂肪肝、癌症和衰老)的热门靶点。
AMPK 的活性受可逆磷酸化的严格调控,而大量脂肪的摄入会阻碍 AMPK 的活性,导致新陈代谢失衡。然而,直到现在,有关脂肪如何在细胞中抑制AMPK活性的研究十分有限,尤其是在活体模型中。
SAPS3参与AMPK的去磷酸化调控
为探究调控AMPK去磷酸化的蛋白质,研究人员利用 Flag 标记的 AMPKα 进行了蛋白质质谱分析,发现磷酸酶PP6的调节亚基SAPS3 和 PP6 的催化亚基可以与AMPK形成复合物。PP6 的催化亚基是真核生物中最保守的蛋白质之一,没有特异性。PP6磷酸酶的特异性调控取决于其调节SAPS3。
那么,含SAPS3的PP6复合物是否能响应葡萄糖匮乏的营养条件将AMPK 去磷酸化呢?蛋白共表达和免疫共沉淀实验表明SAPS3/PP6复合物可在葡萄糖匮乏的条件下与磷酸化的AMPK结合,PP6催化亚基与AMPK的结合需要SAPS3的参与。
研究人员进一步在细胞和小鼠中敲除SAPS3来探索其在AMPK信号通路中的作用。他们发现敲除SAPS3后,即便恢复葡萄糖水平,细胞也无法调控AMPK的去磷酸化。他们还发现在小鼠中进行肝脏特异性 SAPS3敲除足以阻止高脂饮食诱发的肝脂肪变性、肥胖和胰岛素抗性的发生。
图注:SAPS3参与AMPK的去磷酸化调控
图片来源:参考文献【1】
SAPS3的缺失能缓解高脂饮食带来的不利影响
为系统地检查 SAPS3 缺失对肝脏代谢的影响,研究人员分别将对照小鼠(FF,正常表达SAPS3)和肝脏特异性敲除SAPS3小鼠(LKO)喂食对照(CD,均衡饮食)和高脂肪饮食(HFD),之后收集肝脏样本进行代谢分析。实验结果表明喂食高脂饮食后,小鼠SAPS3的缺失可以加强脂肪酸的氧化,降低脂肪酸的合成,从而缓解高脂饮食给小鼠代谢平衡带来的干扰。
图注:小鼠中SAPS3 的肝脏特异性缺失足以改善高脂肪饮食带来的全身反应
图片来源:参考文献【1】
研究人员继续对小鼠的肝脏组织进行了RNA测序(RNA-Seq)来探究在高脂饮食下SAPS3是否从基因转录水平影响小鼠的代谢。RNA 表达谱数据表明,SAPS3 的缺失对均衡饮食影响有限,而对高脂饮食下的基因表达有显著影响。比如脂肪生成和长链脂肪酸合成因 SAPS3 的缺失而受损。令人欣喜的是,SAPS3的敲除降低了心血管疾病发病机制相关基因的转录水平。
图注:高脂饮食和SAPS3敲除对肝脏组织基因转录水平的影响
图片来源:参考文献【1】
AMPK 参与SAPS3的缺失对代谢的调控过程
AMPK在SAPS3 缺失影响肝脏代谢的过程中是否起到了重要作用呢?为了回答这个问题,研究人员在小鼠胚胎成纤维细胞(MEF)中敲除AMPK的组分后,利用13C同位素示踪法研究葡萄糖和脂肪酸的代谢产物。实验结果发现SAPS3的缺失可增强糖酵解中间产物的生成,而AMPK 的敲除则阻断了这一过程。
图注:AMPK参与SAPS3对代谢的调控
图片来源:参考文献【1】
此外,在体内实验中,他们在喂食LKO小鼠16周后使用AMPK非特异性抑制剂Compound C对小鼠进行处理,发现AMPK被抑制后SAPS3的缺失无法缓解高脂饮食对代谢带来的不利影响。
SAPS3抑制剂有望治疗代谢紊乱相关疾病
“去除 SAPS3 抑制成分可以释放这些小鼠体内的 AMPK 激活,使它们在摄入大量脂肪的情况下仍能保持正常的能量平衡,”该研究的通讯作者、UCI分子生物学与生物化学教授 Mei Kong 说,“我们对他们保持正常体重、避免肥胖和患糖尿病的能力感到惊讶。”【2】
这一发现或将启发科学家们采用一种新疗法来治疗与代谢相关的疾病。“如果我们阻断这种抑制活动,我们就可以帮助人们重新激活他们的 AMPK,”Kong 实验室的项目科学家、文章第一作者 Ying Yang 表示,“它可以帮助克服肥胖、糖尿病、脂肪肝等疾病。”
研究人员正致力于开发可以抑制 SAPS3 并恢复代谢平衡的分子化合物。他们计划下一步研究 SAPS3 在癌症、衰老等其他代谢系统紊乱的情况下的作用。
参考文献:
【1】Yang, Y., Reid, M.A., Hanse, E.A. et al. SAPS3 subunit of protein phosphatase 6 is an AMPK inhibitor and controls metabolic homeostasis upon dietary challenge in male mice. Nat Commun 14, 1368 (2023). https://doi.org/10.1038/s41467-023-36809-1
【2】EurekAlert! (n.d.). Study shows how to prevent a high-fat diet from throwing metabolism out of whack. [online] Available at: https://www.eurekalert.org/news-releases/985231 [Accessed 8 Apr. 2023].
来自: 生物谷
更多阅读:
众所周知,肥胖对健康的长期不利影响包括增加心脑血管疾病、高血压、糖尿病以及肿瘤等发病风险。作为当代都市“打工人”,辛勤工作之余最快乐的莫过于来上一顿烤肉大猪肘子抚慰疲惫的灵魂,但也不知不觉便摄入了过多脂肪和热量。作为诱导肥胖的重要因素,关于高脂饮食对机体的影响越来越受到研究人员的关注。
目前的研究表明,长期的高脂饮食能够破坏肠道屏障的完整性和影响肠道菌群的结构[1]。同时一项研究也表明,长期高脂饮食还能够诱导增强小鼠肠道干细胞的增殖能力,促进肿瘤的发生[2]。总是烤肉大肘子要不得,可是偶尔嘴馋吃两口,会怎么样呢?可惜的是,但是目前尚不清楚短期内高脂饮食对机体带来的影响。
近日,来自美国辛辛那提儿童医院医学中心的James M. Wells教授团队在Cell Reports期刊上发表重要研究成果。结果表明高脂饲养24小时即可导致小鼠全身代谢改变以及诱导肠道细胞应激反应。一周内高脂饲料便诱导肠道上皮细胞向吸收“油脂”的方向转变。
都说21天才能养成一个好习惯,“学坏”怎么这么快啊!

下面,让我们了解一下本研究是如何开展的。
首先,研究人员将小鼠随机分为高脂饲料组(HFD,60%脂肪供能)和普通饲料组(Normal Chow,13%脂肪供能)。然后在代谢笼中测定每分钟耗氧量(VO2)及每分钟二氧化碳排出量(VCO2),随后计算呼吸气体交换率(RER,RER=VCO2/VO2)。当RER约等于1时,提示机体主要的功能物质是碳水化合物,而RER向0.7左右靠近时,提示机体向脂肪酸供能转换(图1)。
结果显示,HFD组小鼠24小时后的RER从0.9降到0.8,提示此时机体供能向脂肪酸代谢转换(图1)。这意味着当小鼠摄入短期过多脂肪后,能够迅速地从消耗碳水化合物转向消耗脂肪为机体提供能量。同时,EdU染色还提示HFD干预后小鼠肠基底细胞的增殖能力升高。
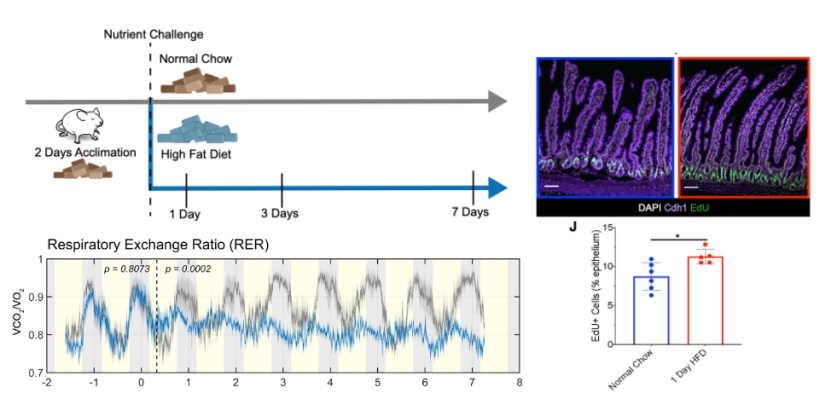
HFD干预1天即可改变小鼠代谢模式及基底细胞增殖能力
发现HFD对小鼠整体代谢的影响后,研究人员然后分别对Normal chow组、HFD干预1天、3天和7天组小鼠的小肠近端组织进行单细胞测序。通过GSEA分析,研究人员发现HFD干预1天和3天后,小鼠肠道细胞中的脂肪酸代谢相关基因显著上调。不过在第7天时,脂肪酸代谢相关基因有所回落。
HFD除了可诱导肠道细胞的脂肪代谢通路上调,HFD同样可能对肠道细胞造成刺激。为此,研究人员构建了一个细胞应激反应评分。结果显示,HFD干预后1天即可诱导肠道细胞的应激反应。
接下来,研究人员进一步探究了不同细胞亚群中细胞转录特征的改变。研究者们首先利用脂质转运及调控相关基因构建了一个脂质吸收评分。结果显示,HFD干预后肠道上皮细胞(Enterocyte)亚群中脂质吸收评分显著升高。同时GO富集分析显示,肠道上皮细胞转录特征向脂质转运通路富集。上述结果表明在短期HFD干预后,肠道上皮细胞增强了对脂质的吸收。
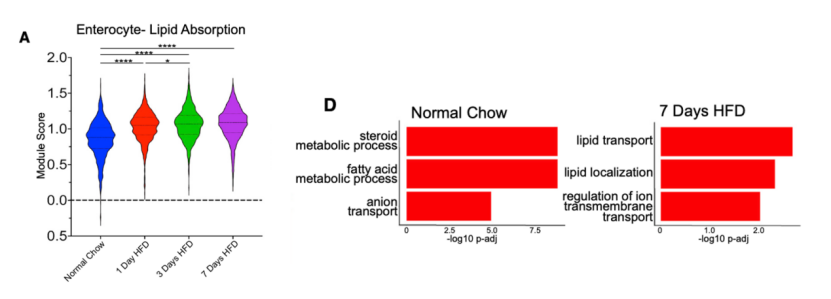
HFD干预后小鼠吸收型肠上皮细胞向脂质转运通路富集
为了验证HFD干预后对肠道上皮细胞脂质吸收能力的影响,研究者们对肠道脂肪组织进行染色。发现HFD干预后1天、3天和7天后,BODIPY和油红O在肠道上皮细胞中均显著富集,证实肠道上皮在短期HFD干预后对脂质的吸收能力增强。
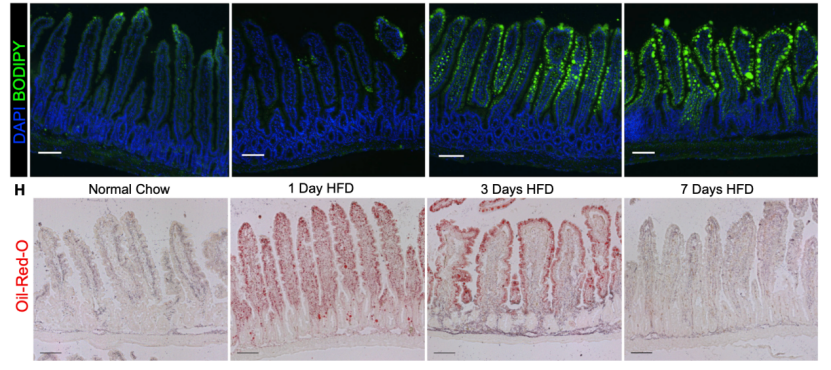
BODIPY和油红O在肠道上皮细胞中染色情况
最后作者猜想,既然短期内HFD造成了肠道细胞的转录组水平改变,那么随着HFD干预的推进,肠道细胞的分化谱系是否也会因为HFD而改变呢?为此,研究者们利用STREAM和PAGA两种单细胞拟时序分析方法对肠道细胞进化轨迹进行分析。
结果表明,HFD干预组的肠道细胞向吸收型上皮细胞转化,而对照组则没有类似的现象。以上的结果代表着,即使是短期的HFD干预,也可能会诱导肠道干细胞向脂质吸收型上皮细胞进行分化。
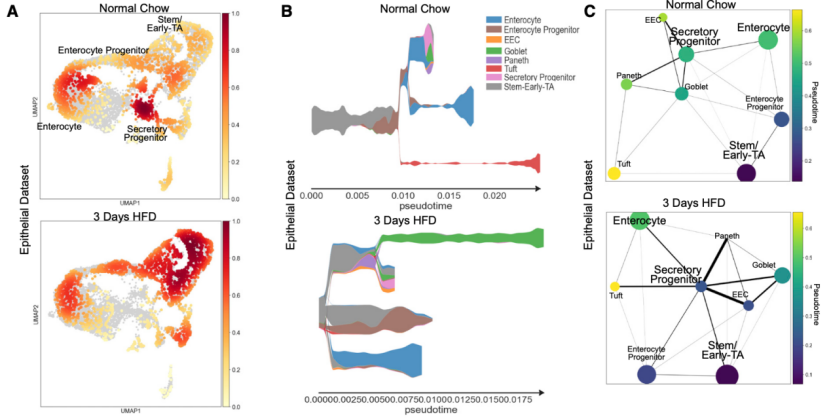
拟时序分析结果提示肠道细胞向吸收型上皮细胞进行转变
最后总结一下,本研究利用小鼠作为模型动物,探究短期内(一周内)HFD喂养对小鼠肠道的影响。研究人员为此不仅利用代谢笼发现小鼠经HFD喂养后整体代谢水平向脂质代谢转变,也在组织和单细胞水平证实1周内HFD即可诱导肠道细胞应激反应以及肠道上皮细胞向吸收“油脂”的方向转变。
不得不感叹,生物体的适应能力真是极其强大。从进化的角度来看,这或许是早期生物体在自然界中由于食物匮乏而遗留下来的一套机制。但对大多数人来说,如今已经处在一个能量摄入过剩的时代。这套既往有利于生物在恶劣环境中生存下来的机制放在今天,可能就会加重肥胖的发生。
高脂饮食是健康的一大威胁已逐渐被人们所认识。相应的,“脂肪”似乎也成为了众矢之的。但实际上,关于饮食模式的研究十分复杂,涉及到不同组分(主要为碳水化合物、脂肪、蛋白质)之间的占比。现有的研究表明,不同脂肪供能占比的饮食模式对人体似乎也有着不同的影响。一项人体中进行的试验表明,同等热量下,脂肪供能约30%的高脂饮食似乎有利于血糖的稳态及降低血甘油三酯[3]。同时,近年来火出圈的生酮饮食(绝大部分供能物质为脂肪,同时低碳水),不仅有利于减肥,还有利于维持餐后血糖水平,或可用于糖尿病的管理[4]。
对于人类来说,尽管西式饮食正逐渐成为工业化社会的主流饮食模式,但其脂肪供能占比一般不超过35%[5]。本研究中使用的动物模型为小鼠,并且使用脂肪供能占比为60%的高脂饮食。相关结果可能在人体中情况会有所出入。相信在未来,关于不同脂肪能量占比的饮食模式对人体肠道的影响还有待进一步探究。
不过总的来说,本研究为我们提供一个很好的参考,即高脂饮食能够快速促进肠道上皮向吸收“油脂”转换。那要如何减肥呢?相信你心中已经有了答案。
来自: 奇点网
更多阅读:
各位减肥混子宝子们,春去夏至清秋近,诸君五花八门的减肥修炼手册进行到哪儿了?先容瘦糕儿宣布个好消息,8小时减肥法的底层逻辑终于找到啦!
没错,又双叒叕是肠道菌群!
在生物科研圈,肠道菌群自带热搜体质这个事大家同意吧,而且与之捆绑的都是诸如代谢、稳态此类的热门话题。
就宿主代谢稳态这方面而言,不得不说,咱们之前的路还是走窄了——有关肠道菌群的大多数研究都集中于大肠或粪便上[1-2]。然而,肠道的其他区域,尤其是消化吸收功能与微生物群组成比较独特的回肠,在调控肠道微环境、生理代谢以及免疫稳态中也发挥了至关重要的作用[3-4]。
这不,美国加州大学的Amir Zarrinpar团队慧眼如炬,针对回肠微生物群及其昼夜节律对宿主代谢健康的影响这一问题展开了系统研究,并在《细胞报告》杂志上发表重要成果,揭示了饮食和进食时间影响小鼠回肠微生物群组成及转录组昼夜节律的机制[5]。
这项研究指出,饮食诱导的肥胖(DIO)会破坏回肠微生物群组成及转录组的昼夜节律,而限时进食(TRF)对这种被扰乱的节律具有纠正作用,并能增加胰高血糖素样肽-1(GLP-1,刺激胰岛素分泌,可通过中枢性食欲抑制减少进食量,从而达到降血糖和减肥等作用)释放,恢复回肠胆汁酸池以及法尼醇 X 受体(FXR)信号转导。这些研究发现为TRF对宿主代谢健康的益处提供了实质性证据。

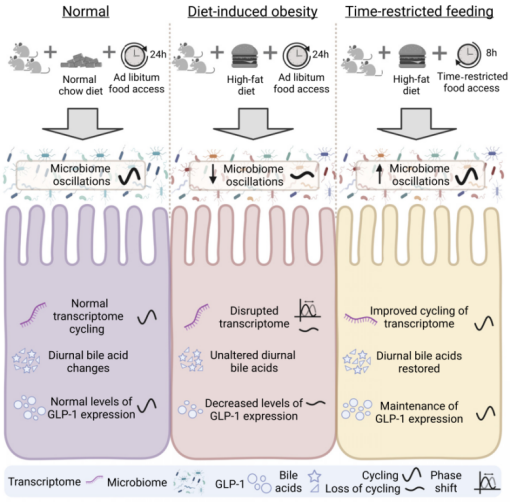
不同饮食和进食模式对回肠微生物群组成及节律性振荡的影响
TRF是将进食时间限制在小鼠活跃期(黑暗条件下)8-10小时内的一类喂养模式,对宿主代谢健康颇有益处。据报道,TRF可减少肥胖和炎症,改善葡萄糖耐受及胆固醇稳态,还能逆转已有的代谢综合征[6-7]。
然而,TRF对宿主代谢益处的机制始终没有得以阐明。不过,既然要探寻饮食对代谢健康的影响,那就跳不过肠道微生物群这一步。
既往研究证据显示,肠道微生物群及其次级代谢产物的昼夜节律对于外周生物钟的调控与肝肠代谢调节因子的节律性表达(维持葡萄糖、胆固醇、脂肪酸稳态以及宿主代谢健康)都是必要的[8]。
但问题是,饮食对肠道微生物群落动力学的改变能否通过昼夜节律而影响宿主代谢?
综合以上信息,Zarrinpar团队设计了三种喂养模式:正常饮食组(NA),自由高脂饮食组(FA)以及限时高脂饮食组(FT),并于每天不同时间点收集各组小鼠的回肠样本,以研究饮食和进食时间对回肠微生物群昼夜节律的影响。
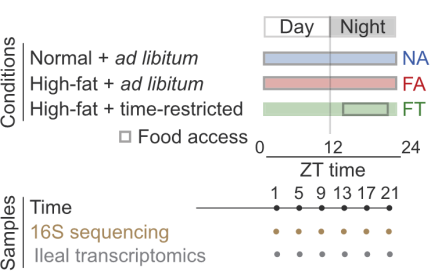
研究设计与样本收集示意图
结果显示,高脂饮食降低了回肠微生物群的α-多样性和β-多样性;FA与FT组小鼠回肠的微生物群组成差异较小,说明饮食种类比进食模式更能影响回肠微生物群组成。
对于回肠微生物群的昼夜节律性,研究人员发现,在FA组小鼠回肠中,保持节律性振荡的菌群丰度不到NA组小鼠的一半,而FT组小鼠则显示出与NA组小鼠相似水平的周期性波动,这初步表明TRF能够改善被高脂饮食扰乱的回肠微生物群的昼夜节律。
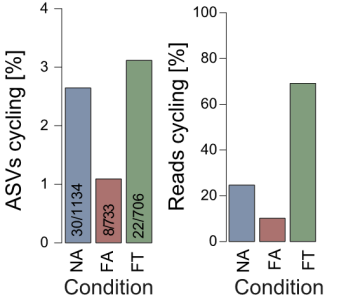
由此可见,TRF确实能够恢复或维持回肠微生物群的昼夜节律。
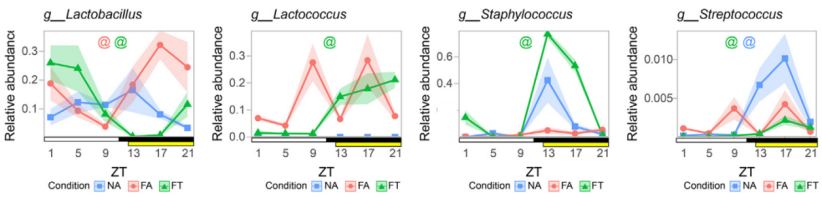
在属水平上特定细菌的相对丰度,“@”表示特定喂养条件下的肠菌节律性
研究报道,肠道微生物群的昼夜节律会影响肝脏转录组[9],浅推一下,回肠转录组是否也会受此影响?
结果显示,与NA相比,FA中周期性转录本显著降低,并通过诱导周期性基因向光照阶段相移而破坏了它们的昼夜节律。
相反,FT不仅维持了与NA相似的转录本水平,还部分恢复了被高脂饮食扰乱的转录本的相位,表明回肠微生物群周期性动力学与TRF对宿主外周生物钟昼夜节律的维持有关。
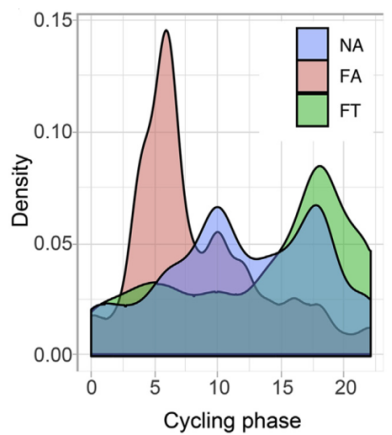
周期性基因的相位分布
此外,FA破坏了回肠中诸多昼夜节律性基因,包括Rev-erb,Per3,Clock,Bmal1,Cry1,Cry2,Ppara和Nfil3,而这些基因在FT中变化不大。
由此可以推测,TRF改善小鼠肥胖和代谢失调可能与其维持回肠昼夜节律、生物钟基因的周期相位以及肠道动态相关。
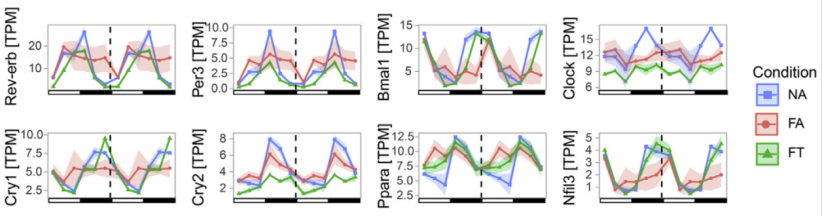
昼夜节律性基因表达双图
那么,TRF是如何通过维持回肠微生物群的昼夜节律而对肠道代谢信号通路产生影响的呢?
研究人员发现,FA条件下,胰高血糖素原基因Gcg(GLP-1前体)和编码GLP-1的基因Dpp4的表达水平均明显降低,并丧失了昼夜节律性,而TRF不仅恢复了Gcg和Dpp4的表达水平,还能维持二者的昼夜节律。
不同喂养模式对GLP-1信号通路转导的影响
除此之外,高脂饮食破坏的胆固醇稳态、胆汁酸池以及胆汁酸转运和再吸收的信号转导也能被TRF逆转。
总的来说,这项研究充分阐明了回肠微生物群组成及转录组昼夜节律对宿主代谢健康的重要作用,在动物水平上为限时进食的代谢益处提供了科学依据,也拉开了回肠在肠道菌群研究舞台中闪亮登场的帷幕!
来自: 奇点网





